Découverte d'une potentielle cible thérapeutique pour lutter contre les trypanosomes
L'équipe de Yaser Hashem du laboratoire Architecture et réactivité de l'ARN du CNRS vient de découvrir une nouvelle cible potentiellement thérapeutique – située dans les ribosomes – pour lutter contre les parasites de la famille des trypanosomes. Grâce à la technique de cryomicroscopie électronique1, ces chercheurs, basés à l'Institut de biologie moléculaire et cellulaire (CNRS / Université de Strasbourg), ont analysé en détail la structure de ces parasites et révélé l'un de leurs points faibles potentiels, passé inaperçu jusqu'à maintenant. Cette découverte ouvre la voie au développement de nouvelles thérapies plus sûres, moins toxiques et plus spécifiques pour combattre les trypanosomes, responsables de la maladie de Chagas ou encore de la maladie du sommeil. Cette étude est publiée le 26 octobre 2017 dans la revue Structure.
Les trypanosomes, appelés plus généralement kinetoplastides, sont des parasites unicellulaires responsables d'une variété de maladies plus ou moins graves, mais qui peuvent parfois être létales. Trypanosoma brucei, Trypanosoma cruzi et Leishmania major sont probablement les plus connus et causent respectivement la maladie du sommeil, la maladie de Chagas et des Leishmanioses.A la différence des bactéries, ces organismes sont des eucaryotes, c'est-à-dire que leurs cellules contiennent un noyau, tout comme les cellules humaines. Les similarités, même faibles, entre les cellules animales et celles des trypanosomes, rendent difficile certaines approches thérapeutiques. En effet, des antibiotiques ciblant des machineries moléculaires données, comme les ribosomes, pourraient endommager, par la même occasion, nos propres cellules. Jusqu'à aujourd'hui, les chercheurs pensaient que les ribosomes d'eucaryotes (impliqués dans la synthèse des protéines) avaient une structure extrêmement similaire d'une espèce d'eucaryotes à une autre comme par exemple entre humains et trypanosomes, les rendant ainsi inattaquables. Les progrès technologiques ont pourtant permis de visualiser les ribosomes des trypanosomes à une résolution quasi atomique et d'en faire ressortir une différence qui pourrait bien devenir une cible thérapeutique.
L'équipe de Yaser Hashem s'est notamment intéressée à l'architecture du ribosome de Trypanosoma cruzi. En utilisant la technique de cryomicroscopie électronique – qui permet de visualiser une structure biologique dans son état natif par cryogénisation de l'échantillon – associée à de la spectrométrie de masse – qui permet de déterminer une composition protéique précise en se basant sur la masse de chaque élément – une protéine spécifique des ribosomes des trypanosomes a pu être mise en évidence : KSRP (kinetoplastid-specific ribosomal protein). En plus d'être spécifique de ces parasites, KSPR est essentielle à leur survie puisque l'inhibition de son activité conduit à la mort des parasites. Cependant le rôle exact de KSRP dans la synthèse de protéines reste à élucider.
La découverte de KSRP laisse entrevoir de futurs progrès dans la recherche médicale pour développer de nouvelles thérapies contre les parasites de la famille des trypanosomes. L'élucidation de la structure de cette nouvelle protéine pourrait permettre de concevoir des molécules capables d'interagir avec elle et l'inhiber de manière hautement spécifique, sans interférer avec les cellules de l'hôte. La possibilité de cibler et inhiber KSRP dans les parasites représente ainsi une alternative plus sûre et surtout plus spécifique comparée aux traitements actuels extrêmement lourds et toxiques.
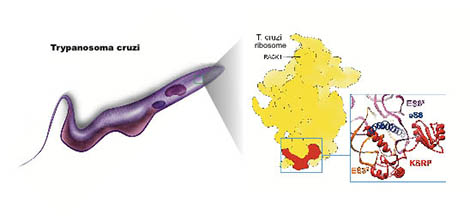
© Yaser Hashem.
Ribosome du parasite Trypanosoma cruzi. Illustration montrant le ribosome cytosolique des trypanosomes, celui-ci est extrait du parasite T. cruzi.
L'analyse de la structure par cryo-microscopie électronique (au milieu)
du ribosome montre l'existence d'une nouvelle protéine, spécifique à
cette famille d'organismes. Cette protéine a été nommée KSRP, pour « Kinetoplastid-specific ribosomal protein
». Malgré sa constance, cette protéine est passée inaperçue des années
durant, même après la publication de la première structure de ce
ribosome à haute résolution.
Télécharger le communiqué de presse :

http://www2.cnrs.fr/presse/communique/5273.htm
Aucun commentaire:
Enregistrer un commentaire