Génétique : un "code origines" pour l'ADN
A l'origine de toute vie, il y a la duplication (ou réplication) de l'ADN, un mécanisme crucial pour la division des cellules. Des biologistes viennent de mener l'analyse la plus exhaustive à ce jour des milliers de sites (appelés origines) où démarre cette réplication du génome chez les organismes multicellulaires. Ils ont pu en distinguer trois grandes catégories, qui reflètent les capacités d'adaptation des cellules. La connaissance de ce "code origines" devrait permettre de rechercher d'éventuelles altérations dans le cancer, voire déboucher sur de nouveaux outils de thérapie génique. Ces résultats, issus principalement d'une collaboration entre des biologistes moléculaires de l'Institut de génétique humaine (CNRS) et des bioinformaticiens du laboratoire Technologie avancée pour le génome et la clinique (TAGC, Inserm/Aix-Marseille Université), sont publiés le 11 novembre 2015 dans la revue Genome Research.
La vie est un éternel recommencement. Pour construire un nouvel organisme à partir de l'unique cellule issue de la fécondation, ou pour renouveler nos tissus (peau, sang…), les cellules se multiplient. Cela commence par la copie (appelée réplication) du patrimoine génétique (l'ADN contenu dans chaque chromosome), avant que la cellule ne se divise en deux copies identiques. La première étape nécessite que les deux brins d'ADN de la double hélice se déroulent et s'ouvrent à la manière d'une fermeture éclair. Puis, chaque brin est recopié, en progressant à partir de cette ouverture, afin de former deux chromosomes identiques.
Chez les organismes pluricellulaires, cette copie démarre simultanément en des milliers de sites sur chaque chromosome, appelés origines de réplication1. Ces sites dessinent une sorte de code-barres sur l'ADN, dont les caractéristiques étaient encore mal comprises.
A partir de cellules souches de souris (dont le génome est très proche du nôtre), l'équipe de Marcel Méchali (dont principalement Christelle Cayrou) à l'Institut de génétique humaine du CNRS, et les bioinformaticiens Jacques van Helden et Benoit Ballester du laboratoire TAGC ont recherché les caractéristiques des origines de réplication. Ils ont croisé les approches pour déterminer à la fois leur séquence (le message héréditaire porté par l'ADN, codé dans un alphabet de quatre lettres) et les marques réversibles qui peuvent être ajoutées sur le chromosome, qualifiées d'épigénétiques.
Ils ont ainsi observé une structure particulière de l'ADN, partagée par 75 % des origines, consistant en un site riche en G (l'une des quatre lettres de l'alphabet génétique) où pourrait s'assembler la machinerie cellulaire utile à la réplication, avant que l'ADN s'ouvre sur un deuxième site situé un peu en aval.
Mais surtout, en voulant dresser un portrait-robot des origines de réplication, les chercheurs sont finalement parvenus à dégager trois grandes catégories, qui semblent s'adapter à différents besoins de la cellule. Par exemple, la classe 1 regroupe des origines qui portent peu de marques épigénétiques, assez isolées, situées dans des régions pauvres en gènes, qui sont recopiées assez tardivement lors de la réplication. La classe 3, elle, rassemble des origines situées dans des régions riches en gènes, et notamment en gènes impliqués dans le développement embryonnaire ou la différenciation des cellules.
Ce "code origines" pourrait expliquer la flexibilité d'utilisation des origines, sans doute en lien avec les capacités d'adaptation des cellules face aux conditions rencontrées. En effet, sur les 65 000 à 100 000 origines du génome humain, seul un tiers est mobilisé lors d'un cycle de réplication donné. Mais les autres sont loin d'être superflues. Une partie sert de réserve anti-stress : si des erreurs ou des cassures provoquées par des agents externes bloquent la réplication à un endroit donné, elle peut redémarrer à partir d'une autre origine de réserve. Une autre partie des origines excédentaires peut permettre une adaptation en fonction du destin cellulaire : selon les types cellulaires (neurone, globule blanc…), les chromosomes sont repliés différemment dans le noyau et les parties du chromosome accessibles ne sont pas les mêmes.
Ce travail très fondamental n'est pas sans applications potentielles. En effet, des anomalies lors de la réplication peuvent provoquer des réarrangements du génome tels que ceux rencontrés dans les cellules cancéreuses. Le déchiffrement du "code origines" va donc permettre de rechercher d'éventuelles altérations de ce code qui pourraient contribuer aux cancers. Il pourrait aussi ouvrir sur des traitements bloquant les origines dans les cellules cancéreuses, afin d'arrêter leur prolifération. Enfin, les chercheurs espèrent mettre au point de nouveaux outils de thérapie génique. En concevant des origines de réplication très efficaces, ils pourraient construire des vecteurs2 de gènes capables de se comporter dans les cellules comme un mini-chromosome supplémentaire, assurant le maintien à long terme du gène-médicament, tout en évitant les inconvénients des vecteurs viraux3 utilisés à l'heure actuelle.

Chez les organismes pluricellulaires, cette copie démarre simultanément en des milliers de sites sur chaque chromosome, appelés origines de réplication1. Ces sites dessinent une sorte de code-barres sur l'ADN, dont les caractéristiques étaient encore mal comprises.
A partir de cellules souches de souris (dont le génome est très proche du nôtre), l'équipe de Marcel Méchali (dont principalement Christelle Cayrou) à l'Institut de génétique humaine du CNRS, et les bioinformaticiens Jacques van Helden et Benoit Ballester du laboratoire TAGC ont recherché les caractéristiques des origines de réplication. Ils ont croisé les approches pour déterminer à la fois leur séquence (le message héréditaire porté par l'ADN, codé dans un alphabet de quatre lettres) et les marques réversibles qui peuvent être ajoutées sur le chromosome, qualifiées d'épigénétiques.
Ils ont ainsi observé une structure particulière de l'ADN, partagée par 75 % des origines, consistant en un site riche en G (l'une des quatre lettres de l'alphabet génétique) où pourrait s'assembler la machinerie cellulaire utile à la réplication, avant que l'ADN s'ouvre sur un deuxième site situé un peu en aval.
Mais surtout, en voulant dresser un portrait-robot des origines de réplication, les chercheurs sont finalement parvenus à dégager trois grandes catégories, qui semblent s'adapter à différents besoins de la cellule. Par exemple, la classe 1 regroupe des origines qui portent peu de marques épigénétiques, assez isolées, situées dans des régions pauvres en gènes, qui sont recopiées assez tardivement lors de la réplication. La classe 3, elle, rassemble des origines situées dans des régions riches en gènes, et notamment en gènes impliqués dans le développement embryonnaire ou la différenciation des cellules.
Ce "code origines" pourrait expliquer la flexibilité d'utilisation des origines, sans doute en lien avec les capacités d'adaptation des cellules face aux conditions rencontrées. En effet, sur les 65 000 à 100 000 origines du génome humain, seul un tiers est mobilisé lors d'un cycle de réplication donné. Mais les autres sont loin d'être superflues. Une partie sert de réserve anti-stress : si des erreurs ou des cassures provoquées par des agents externes bloquent la réplication à un endroit donné, elle peut redémarrer à partir d'une autre origine de réserve. Une autre partie des origines excédentaires peut permettre une adaptation en fonction du destin cellulaire : selon les types cellulaires (neurone, globule blanc…), les chromosomes sont repliés différemment dans le noyau et les parties du chromosome accessibles ne sont pas les mêmes.
Ce travail très fondamental n'est pas sans applications potentielles. En effet, des anomalies lors de la réplication peuvent provoquer des réarrangements du génome tels que ceux rencontrés dans les cellules cancéreuses. Le déchiffrement du "code origines" va donc permettre de rechercher d'éventuelles altérations de ce code qui pourraient contribuer aux cancers. Il pourrait aussi ouvrir sur des traitements bloquant les origines dans les cellules cancéreuses, afin d'arrêter leur prolifération. Enfin, les chercheurs espèrent mettre au point de nouveaux outils de thérapie génique. En concevant des origines de réplication très efficaces, ils pourraient construire des vecteurs2 de gènes capables de se comporter dans les cellules comme un mini-chromosome supplémentaire, assurant le maintien à long terme du gène-médicament, tout en évitant les inconvénients des vecteurs viraux3 utilisés à l'heure actuelle.

© Slavica Stanojcik et Marcel Méchali
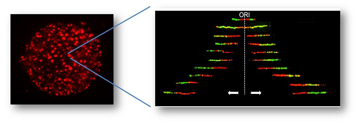
La réplication s'effectue dans le noyau de la cellule (à gauche) et se visualise à de multiples endroits par la présence de foyers détectables par l'incorporation de nucléotides fluorescents (points rouges). Dans chaque foyer, la réplication démarre à partir d'origines de réplication et progresse à droite et à gauche des fibres d'ADN. A droite, deux nucléotides fluorescents (vert et rouge) sont ajoutés l'un après autre et montrent la progression de la réplication.

© Adrien Méchali
Déchiffrement du code origines : pour démarrer sa duplication, l'ADN illustré ici par une fermeture éclair, s'ouvre en plusieurs endroits précis appelés origines de réplication. Il y en a plus de 50 000 dans l'ADN de chaque cellule. Trois types de code bien précis définissent ces endroits (bleu, orange et vert sur le dessin), qui ont pu être déchiffrés dans ces travaux. Au cours de la duplication, chaque brin de la fermeture éclair reconstitue une fermeture-éclair complète. L'ADN de chaque cellule est ainsi dupliqué et partagé dans les deux cellules filles.
Notes :
1 S'il y avait une seule origine par chromosome, la division d'une cellule humaine durerait un mois (au lieu de 24 heures environ) et il faudrait 60 ans pour faire un bébé complet.
2 En thérapie génique, un vecteur est chargé de transporter un gène-médicament jusqu'à l'intérieur des cellules à soigner.
3 Parmi ces inconvénients, on peut citer la possible réaction immunitaire contre ces vecteurs, ou encore des effets indésirables liés à l'intégration non ciblée de certains vecteurs dans le génome.
2 En thérapie génique, un vecteur est chargé de transporter un gène-médicament jusqu'à l'intérieur des cellules à soigner.
3 Parmi ces inconvénients, on peut citer la possible réaction immunitaire contre ces vecteurs, ou encore des effets indésirables liés à l'intégration non ciblée de certains vecteurs dans le génome.
Références :
The chromatin environment shapes replication origin organization and defines origin classes, Christelle Cayrou, Benoit Ballester, Isabelle Peiffer, Romain Fenouil, Philippe Coulombe, Jean-Christophe Andrau, Jacques van Helden et Marcel Méchali. Genome Research, 11 novembre 2015.
DOI : 10.1101/gr.192799.115 Consulter le site web
DOI : 10.1101/gr.192799.115 Consulter le site web
Aucun commentaire:
Enregistrer un commentaire