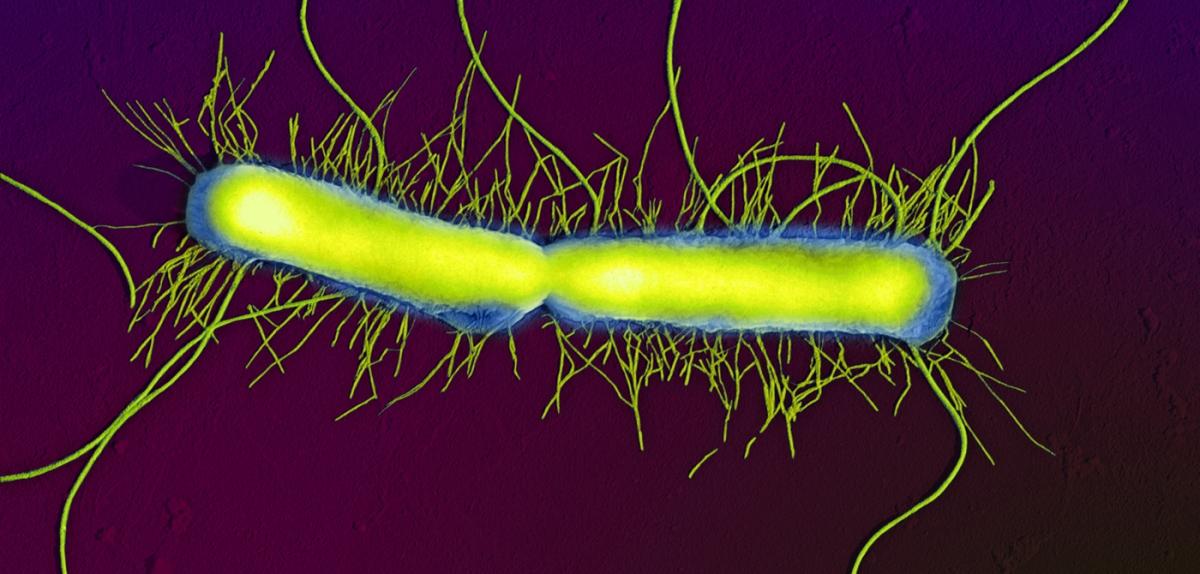
Bactérie Proteus vulgaris vue au microscope électronique à
balayage (grossissement x16000). Cette bactérie est naturellement
présente dans le microbiote intestinal mais peut devenir pathogène chez
les sujets immuno-déprimés.
Il pèse entre un et cinq kilos, vit dans vos intestins et se nourrit
de ce que vous avalez. Mais loin de vous être hostile, le microbiote est
votre indispensable allié.
Sans le microbiote, une colonie de bactéries tapissant les quelques
400m2 de la surface intestinale, nous serions incapables d'assimiler
certains aliments que seules les bactéries savent dégrader. On parle de
symbiotisme car ni cette flore intestinale ni son hôte ne peuvent
survivre l’un sans l’autre. Celle-ci se montre même capable de réguler
l'expression de certains de nos gènes, et les chercheurs soupçonnent que
de nombreuses maladies sont liées à des déséquilibres dans la diversité
bactérienne. Dès lors, la question s’est posée de savoir s’il était
possible de manipuler ce microbiote à des fins thérapeutiques ou juste
diagnostiques.
Les changements d'alimentation peuvent avoir un effet très
rapide sur la composition du microbiote : l'absence de nourriture, mais
aussi l’apport de protéines ou de fibres solubles dans l’alimentation
peuvent modifier la biodiversité des bactéries présentes, et induire une
dépense d'énergie plus importante, un stockage des graisses diminué et
une sensation de satiété, autant d'effets bénéfiques en cas d'obésité ou
de diabète.
Encore plus récemment, des chercheurs de l’INRA ont
réussi à mettre au point un test, non invasif et fiable à plus de
90%, qui permet d’identifier les personnes atteintes de cirrhose du
foie. Celui-ci consiste à analyser les selles du patient et y rechercher
l'abondance relative de 7 espèces bactériennes. En effet, chez les
patients cirrhotiques, on s'est aperçu que jusqu’à 40% du microbiote
intestinal est constitué de bactéries qui, chez les personnes saines,
sont rares dans l’intestin mais fréquentes dans la bouche. L’explication
proposée serait que la bile des personnes malades n’est plus en mesure
d’empêcher la migration des bactéries de la bouche vers le tube
digestif. D’autres études ont en outre montré que ces bactéries buccales
sont plus abondantes chez les personnes atteintes de cancers
colorectaux ou souffrant de la maladie de Crohn que chez les individus
sains. Ainsi contrôler et combattre cet envahissement de l’intestin par
les bactéries qui lui sont normalement étrangères, constitue une
stratégie thérapeutique particulièrement prometteuse contre ces maladies
graves.
Comment étudier le microbiote?
Notre flore intestinale est composée d'environ 100 000 milliards de bactéries. On arrive à cultiver certaines espèces à partir des selles mais la plupart sont méconnues et non cultivables. Ce sont les récents progrès des techniques de séquençage de l’ADN qui ont permis, par le décompte des gènes, de découvrir la diversité insoupçonnée des groupes bactériens intestinaux. A l’aide d’une nouvelle méthode d’analyse du métagénome de l'intestin mise au point au sein du consortium MetaHIT pilotée par l’Inra et impliquant des équipes du CEA, du CNRS et de l’Université d’Evry, les chercheurs ont analysé 396 échantillons de selles d’individus espagnols et danois. Ils ont ainsi identifié 741 espèces de bactéries dont 85% étaient jusque-là inconnues. Cette méthode a également permis de reconstituer le génome complet de 238 bactéries intestinales. L’étude, publiée en juillet dans Nature, a par ailleurs mis en évidence des centaines de relations de dépendances entre ces différents groupes bactériens ; ce qui, à l’avenir facilitera leur détection mais aussi la compréhension du fonctionnement global de la population microbienne intestinale et ses interactions avec l’organisme qui les héberge : régime alimentaire, profil immunitaire, etc...
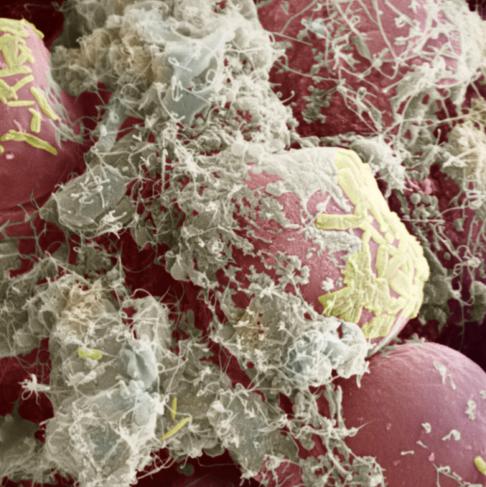
Muqueuse intestinale humaine vue au microscope électronique à
balayage (grossissement x8750). Des bactéries et des débris tapissent
les cellules de cette muqueuse.
Change-t-il avec notre alimentation ?
On s’est aperçu que la composition de la flore s’adapte aux changements de nourriture. Par exemple, contrairement à ce que l’on pourrait penser, le poids de ce microbiote (1 à 5 kg) ne dépend pas du poids total de l'individu mais de son type d'alimentation.
Chez l'homme, on constate une perte de diversité dans la flore microbienne des populations obèses
Toutefois, en dépit des perturbations qu’on lui impose, cet
écosystème fait preuve d’une certaine inertie et garde une "signature"
propre à chaque individu. Dès lors, deux stratégies thérapeutiques
peuvent être envisagées pour agir sur cette biodiversité: une approche
probiotique, où l'on transfère directement dans l’intestin de l’hôte les
groupes bactériens que l’on souhaite y introduire, et une approche
prébiotique qui consiste à ingérer des composés alimentaires (comme des
fibres solubles) qui vont modifier le microbiote.
A-t-il un intérêt thérapeutique?
Les essais de transfert de microbiote chez l'animal et chez l'homme ont ouvert des pistes très prometteuses, par exemple dans le traitement de l'obésité ou pour prévenir certaines inflammations intestinales graves, le diabète ou les maladies cardiovasculaires. La transplantation de microbiote fécal consiste à introduire les selles d’un donneur sain dans le tube digestif d’un patient receveur afin de rééquilibrer sa flore intestinale altérée. Cette approche thérapeutique suscite un intérêt grandissant et a fait l’objet de plusieurs études montrant des résultats encourageants. Une équipe néerlandaise a ainsi pu démontrer en 2013 que le transfert de flore était bien plus efficace qu’une antibiothérapie dans le traitement de l’infection par la bactérie Clostridium difficile. A tel point qu’il a été décidé d’interrompre l’essai lors des tests cliniques, événement rarissime. Plus récemment, la Société américaine de Gastroentérologie a institué le transfert de flore comme alternative au traitement antibiotique des infections récidivantes, solution préconisée également par la Société européenne de Microbiologie clinique et d’Infectiologie.
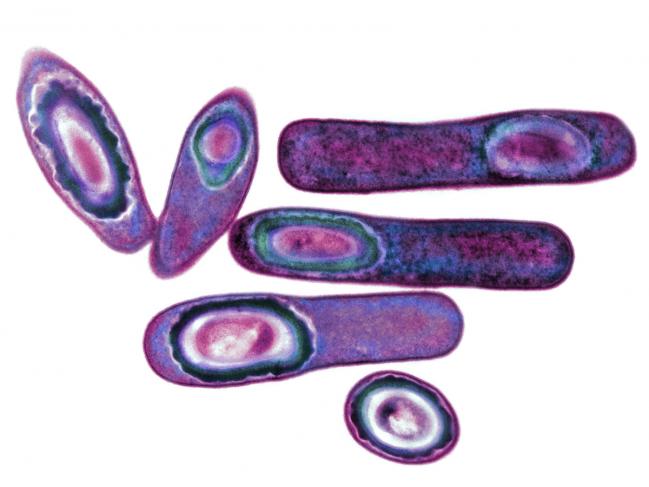
Vue colorisée de bactéries Clostridium difficile grossie au
microscope électronique à transmission (grossissement x11000). C. diff
fait partie du microbiote intestinal humain normal. En raison des
résistances qu'elle a développées, elle peut proliférer de manière
pathologique à la suite d'une antibiothérapie qui élimine les autres
espèces bactériennes.
Modifie-t-il le comportement alimentaire ?
Si comme on l’a vu, l’alimentation influe sur la composition de la flore intestinale, réciproquement, celle-ci peut influer sur le comportement alimentaire. Véritable usine à fermentation, le microbiote est indispensable à l’assimilation des fibres et sucres complexes. Cette digestion bactérienne produit des petits lipides, des acides gras à courtes chaînes, qui stimulent la production de glucose par l’intestin . De fait, lorsque l'organisme est privé de sucre, on constate que certains organes prennent le relais et se mettent à produire du glucose : d'abord le foie, puis les reins au bout de 20/24h. « Le résultat inattendu a été de découvrir que l'intestin lui-même peut dans certaines conditions fabriquer du glucose. » se souvient Gilles Mithieux, directeur de recherche CNRS sur les mécanismes moléculaires du diabète et de l'unité « Nutrition et cerveau » (Inserm / Université Claude Bernard Lyon 1). Ce glucose libéré dans le sang entraîne une diminution de la sensation de faim, exerçant ainsi un effet anti-obésité et anti-diabète.Le microbiote peut-il facilement être transplanté ?
Si l'alimentation est un déterminant essentiel de la biodiversité du microbiote, elle n’explique pas tout : notre système immunitaire joue également un rôle en tolérant certaines bactéries et en éliminant systématiquement d’autres. Plusieurs études ont ainsi montré que si l'on transfère la flore intestinale d'un animal normal sur un animal obèse, il maigrit.
En dépit des perturbations qu’on lui impose,
le microbiote fait preuve d’une certaine inertie et garde une signature
propre à chaque individu
Toutefois, l'effet de ce transfert de flore microbienne reste
temporaire et s'estompe si sa nourriture est trop riche. L'inverse
fonctionne également, on peut rendre obèse un animal normal. Chez
l'homme, on a constaté une perte de diversité bactérienne dans la flore
microbienne de la population obèse. L'une des hypothèses est que la
présence de certains groupes entraîne une modification des fonctions
bactériennes qui influent sur le stockage de graisse.
Reste que pour l'instant ces études demeurent peu reproductibles et les résultats observés transitoires. Le microbiote constitue en effet un écosystème ou s’intriquent des centaines d’associations entre espèces. Sans intervention extérieure, l'écosystème s’autorégule, les bactéries se contrôlant mutuellement en synthétisant des peptides antimicrobiens. Mais par exemple, lorsqu'il y a prise d'antibiotique, certaines bactéries se révèlent résistantes mais l'antibiotique tue les autres : le traitement déplace alors le point d’équilibre de l’écosystème.
https://lejournal.cnrs.fr/articles/microbiote-des-bacteries-qui-nous-veulent-du-bien
Reste que pour l'instant ces études demeurent peu reproductibles et les résultats observés transitoires. Le microbiote constitue en effet un écosystème ou s’intriquent des centaines d’associations entre espèces. Sans intervention extérieure, l'écosystème s’autorégule, les bactéries se contrôlant mutuellement en synthétisant des peptides antimicrobiens. Mais par exemple, lorsqu'il y a prise d'antibiotique, certaines bactéries se révèlent résistantes mais l'antibiotique tue les autres : le traitement déplace alors le point d’équilibre de l’écosystème.
https://lejournal.cnrs.fr/articles/microbiote-des-bacteries-qui-nous-veulent-du-bien
Aucun commentaire:
Enregistrer un commentaire